
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Última modificação 2025-01-22 17:07.
O cloro isótopo com 18 nêutrons tem uma abundância de 0,7577 e um número de massa de 35 amu. Para calcular o média massa atômica, multiplique a fração pelo número de massa para cada isótopo e, em seguida, adicione-os.
Da mesma forma, qual é a média ponderada de todos os isótopos de um elemento?
Usando as massas dos diferentes isótopos e quão abundante cada isótopo é, podemos encontrar o média massa dos átomos de um elemento . A massa atômica de um elemento é o média ponderada massa dos átomos em uma amostra de ocorrência natural do elemento . A massa atômica é normalmente relatada em unidades de massa atômica.
o que tem uma massa de 1 amu? Uma unidade de massa atômica (simbolizada AMU ou amu) é definida como precisamente 1/12 da massa de um átomo de carbono-12. O átomo de carbono-12 (C-12) tem seis prótons e seis nêutrons em seu núcleo. Em termos imprecisos, um AMU é a média do próton massa de descanso e o nêutron massa de repouso.
Em segundo lugar, como você calcula a abundância percentual usando a massa atômica?
Mudar cada abundância de porcentagem na forma decimal, dividindo por 100. Multiplique este valor pelo massa atômica desse isótopo. Some para cada isótopo para obter a média massa atômica.
Qual é a diferença entre massa atômica e peso atômico?
Massa atômica (muma) é o massa de um átomo . Um único átomo tem um número definido de prótons e nêutrons, então o massa é inequívoco (não muda) e é a soma do número de prótons e nêutrons no átomo . Peso atômico é uma média ponderada de massa de todos os átomos de um elemento, com base na abundância de isótopos.
Recomendado:
Como você encontra a velocidade média com duas velocidades?
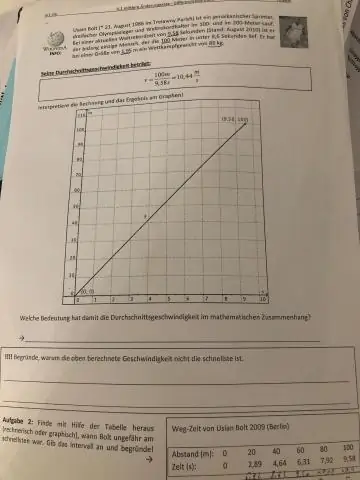
A soma da velocidade inicial e final é dividida por 2 para encontrar a média. A calculadora de velocidade média usa a fórmula que mostra que a velocidade média (v) é igual à soma da velocidade final (v) e da velocidade inicial (u), dividida por 2
Como você interpreta a média ponderada?

Resumo. Média ponderada: uma média em que alguns valores contribuem mais do que outros. Quando os pesos somam 1: apenas multiplique cada peso pelo valor correspondente e some tudo. Caso contrário, multiplique cada peso w por seu valor correspondente x, some tudo e divida pela soma dos pesos: Média ponderada = Σ wx Σ w
Como você encontra o número que falta quando informa a média?

A média de um conjunto de números é a média desses números. Você pode encontrá-lo adicionando o conjunto de números e dividindo por quantos números são dados. Se você receber um hemograma e for solicitado a encontrar um número ausente no conjunto, use uma equação simples
Como você cria uma média ponderada em uma tabela dinâmica?

Médias ponderadas em uma tabela dinâmica Clique na seta para baixo ao lado da palavra Tabela Dinâmica no lado esquerdo da barra de ferramentas Tabela Dinâmica. Escolha fórmulas | Campos calculados. Na caixa Nome, digite um nome para o seu novo campo. Na caixa Fórmula, insira a fórmula que deseja usar para sua média ponderada, como = ValorPonderado / Peso. Clique OK
Qual é a massa média ponderada?

A massa atômica de um elemento é a média ponderada das massas dos isótopos de um elemento. A massa atômica de um elemento pode ser calculada desde que as abundâncias relativas dos isótopos naturais do elemento e as massas desses isótopos sejam conhecidas
