
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Última modificação 2025-01-22 17:07.
12,38 Qual de cada par tem a superior pressão de vapor (a) C2H6 ou C4H10 : C2H6 tem a superior pressão de vapor. Existem apenas forças de dispersão, e estas são mais fortes nas mais pesadas C4H10 molécula. Em casos como este, as moléculas mais pesadas, que tem forças de dispersão mais fortes, tenho a ponto de ebulição mais alto.
Conseqüentemente, c3h8 ou c4h10 tem um ponto de ebulição mais alto?
C2H6 < C3H8 < C4H10 . Todos esses compostos são apolares e apenas tenho Forças de dispersão de Londres: quanto maior a molécula, maiores as forças de dispersão e a superior a ponto de ebulição.
Da mesma forma, qual teria um ponto de ebulição mais alto? A força relativa das quatro forças intermoleculares é: Iônico> Ligação de hidrogênio> dipolo dipolo> Forças de dispersão de Van der Waals. A influência de cada uma dessas forças atrativas vai dependem dos grupos funcionais presentes. Pontos de ebulição aumentam à medida que o número de carbonos aumenta.
Também saiba, qual composto você esperaria ter o ponto de ebulição mais alto?
Quanto mais forte for a força intermolecular, o superior a ponto de ebulição . Em geral, a ligação de hidrogênio é mais forte do que as atrações dipolo-dipolo, que estão mais forte do que as forças de dispersão de Londres.
Como você determina o ponto de ebulição?
Exemplo de elevação de ponto de ebulição
- A glicose é o nosso soluto e a água é o solvente.
- Kb para a água é 0,51 graus Celsius kg / mol.
- A massa molar da glicose é 180 g / mol.
- O ponto de ebulição da água é 100 graus Celsius.
- A equação para elevação do ponto de ebulição é delta T = mKb.
Recomendado:
Qual tem o ponto de ebulição mais alto CCl4 cf4 ou CBr4?

O dependem do número de elétrons. CBr4 tem 146, em comparação com 42 em CF4 e 74 em CCl4. CBr4 é o ponto de ebulição mais alto
O etano ou o eteno têm um ponto de ebulição mais alto?

O etano tem atrações intermoleculares mais fortes (forças de van der Waal) do que o eteno e, portanto, tem o ponto de ebulição mais alto
Por que o álcool etílico tem um ponto de ebulição mais alto do que o álcool metílico?

O etanol tem ponto de ebulição mais alto do que o metanol. Portanto, mais energia é necessária para superar as forças intermoleculares, resultando no aumento dos pontos de ebulição / fusão
O etanol ou a acetona têm um ponto de ebulição mais alto?

Portanto, o etanol (com a capacidade de ligação H) deve ter o ponto de ebulição mais alto, com a acetona polar tendo o próximo ponto de ebulição mais alto, e o não polarpropano, com as forças intermoleculares mais fracas, terá o ponto de ebulição mais baixo. 41
Por que a água tem um alto ponto de ebulição e ponto de fusão?
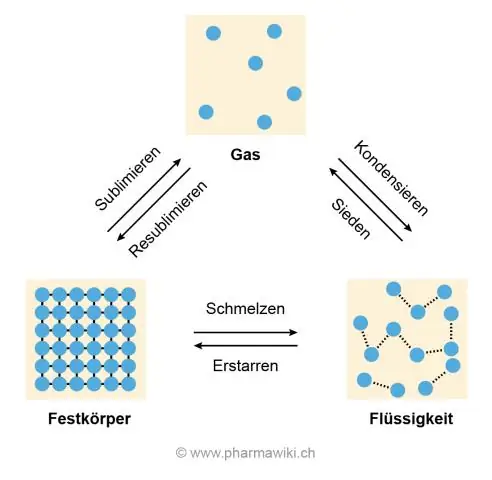
A razão para as altas temperaturas de derretimento e ebulição é a ligação de hidrogênio entre as moléculas de água que faz com que elas fiquem juntas e resistam à separação, que é o que acontece quando o gelo derrete e a água ferve para se tornar um gás
