
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Última modificação 2025-01-22 17:07.
VÍDEO
Então, como você resolve os problemas de massa atômica?
Para calcular a massa atômica de um único átomo de um elemento, some o massa de prótons e nêutrons. Exemplo: Encontre o massa atômica de um isótopo de carbono que possui 7 nêutrons. Você pode ver na tabela periódica que o carbono tem um atômico número de 6, que é o seu número de prótons.
Além disso, o que é o número de massa atômica? o Número de massa (símbolo A, da palavra alemã Atomgewicht [ atômico peso]), também chamado número de massa atômica ou núcleon número , é o total número de prótons e nêutrons (juntos conhecidos como núcleons) em um atômico núcleo. o Número de massa é diferente para cada isótopo diferente de um elemento químico.
Também saber é, qual é a fórmula da massa atômica?
Média massa atômica = f1M1 + f2M2 +… + F M onde f é a fração que representa a abundância natural do isótopo e M é o massa número (peso) do isótopo. A média massa atômica de um elemento pode ser encontrado na tabela periódica, normalmente sob o símbolo elemental.
Qual é a massa atômica média em química?
o massa atômica média de um elemento é a soma do missas de seus isótopos, cada um multiplicado por sua abundância natural (o decimal associado com a porcentagem de átomos desse elemento que são de um determinado isótopo).
Recomendado:
Como você calcula a massa atômica média do estrôncio?

Então, nós o calculamos pegando a massa ponderada de cada um dos isótopos e somando-os. Então, para a primeira massa, vamos multiplicar 0,50% de 84 (amu - unidades de massa atômica) = 0,042 amu, e adicioná-lo a 9,9% de 86 amu = 8,51 amu, e assim por diante
Como você calcula a massa atômica do boro?
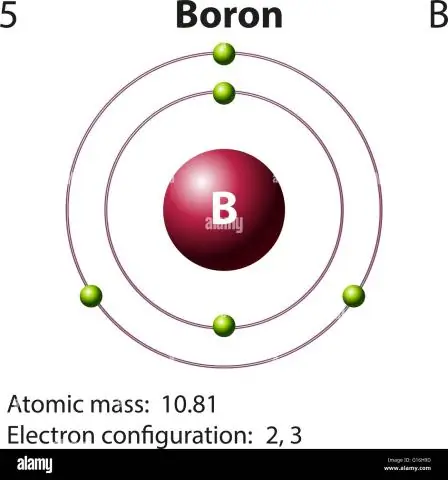
Para o boro, esta equação será parecida com esta: 5 prótons + 5 nêutrons = 10 unidades de massa atômica (AMU) ou, para o isótopo de boro que ocorre mais comumente (aprox. 5 prótons + 6 nêutrons = 11 AMU
Como você resolve problemas de limitação de massa de reagente?

Encontre o reagente limitante calculando e comparando a quantidade de produto que cada reagente irá produzir. Equilibre a equação química para a reação química. Converta as informações fornecidas em moles. Use a estequiometria para cada reagente individual para encontrar a massa do produto produzido
Quais são os usos da liga forjada na prática odontológica?

Exemplos do uso de ligas trabalhadas em odontologia incluem materiais para fazer instrumentos e brocas, fios e, ocasionalmente, bases para dentaduras. O aço e o aço inoxidável são as ligas forjadas mais amplamente utilizadas e, portanto, merecem uma discussão detalhada
Como você calcula os problemas de titulação?

Problema de titulação Solução passo a passo Etapa 1: Determine [OH-] Cada mol de NaOH terá um mol de OH-. Etapa 2: Determine o número de moles de OH- Molaridade = número de moles / volume. Etapa 3: Determine o número de moles de H + Etapa 4: Determine a concentração de HCl
