
Índice:
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Última modificação 2025-01-22 17:07.
No número de oxidação método, você determina o números de oxidação de todos os átomos. Então você multiplica os átomos que mudaram por pequenos inteiros números . Você está tornando a perda total de elétrons igual ao ganho total de elétrons. Então você Saldo o resto dos átomos.
Conseqüentemente, como você equilibra as equações de redução da oxidação?
Siga estas regras para equilibrar equações redox simples:
- Escreva as semirreações de oxidação e redução para as espécies que são reduzidas ou oxidadas.
- Multiplique as semi-reações pelo número apropriado para que tenham o mesmo número de elétrons.
- Adicione as duas equações para cancelar os elétrons.
Em segundo lugar, como você equilibra as equações? Método 1 Fazendo um Equilíbrio Tradicional
- Escreva sua equação dada.
- Escreva o número de átomos por elemento.
- Guarde o hidrogênio e o oxigênio para o final, já que eles costumam estar nos dois lados.
- Comece com elementos únicos.
- Use um coeficiente para equilibrar o átomo de carbono individual.
- Equilibre os átomos de hidrogênio a seguir.
- Equilibre os átomos de oxigênio.
Além disso, como você equilibra facilmente as equações químicas?
Em geral, para equilibrar uma equação, aqui estão as coisas que precisamos fazer:
- Conte os átomos de cada elemento nos reagentes e nos produtos.
- Use coeficientes; coloque-os na frente dos compostos conforme necessário.
O C o2 co2 é uma reação redox?
É C + O2 = CO2 um intramolecular reacção redox ou não? Um reagente (carbono) é oxidado e o outro (oxigênio) é reduzido. Portanto, este é um simples intermolecular reacção redox . Algum reação em que um ou mais reagentes / produtos por acaso sejam elementos puros deve ser um reacção redox.
Recomendado:
Que tipos de números constituem o conjunto de números chamados de números reais?

Conjuntos de números reais (inteiros positivos) ou os números inteiros {0, 1, 2, 3,} (os inteiros não negativos). Os matemáticos usam o termo "natural" em ambos os casos
O que são números naturais, números inteiros, inteiros e números racionais?
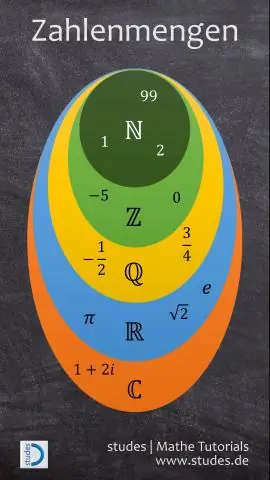
Os números reais são classificados principalmente em números racionais e irracionais. Os números racionais incluem todos os inteiros e frações. Todos os inteiros negativos e números inteiros constituem o conjunto de inteiros. Os números inteiros são compostos por todos os números naturais e zero
Como você resolve números complexos e números imaginários?

Os números complexos têm a forma a + bi a + b i, onde aeb são números reais ei é a raiz quadrada de &menos; 1. Todos os números reais podem ser escritos como números complexos definindo b = 0. Os números imaginários têm a forma bi e também podem ser escritos como números complexos definindo a = 0
Como você equilibra exemplos de equações químicas?

Exemplos de 10 Equações Químicas Balanceadas Escrever equações químicas balanceadas é essencial para a aula de química. 6 CO2 + 6 H2O → C6H12O6 + 6 O2 (equação balanceada para fotossíntese) 2 AgI + Na2S → Ag2S + 2 NaI. Ba3N2 + 6 H2O → 3 Ba (OH) 2 + 2 NH3 3 CaCl2 + 2 Na3PO4 → Ca3 (PO4) 2 + 6 NaCl. 4 FeS + 7 O2 → 2 Fe2O3 + 4 SO2
Como você equilibra as seguintes equações?

VÍDEO Com relação a isso, como você equilibra uma equação química? Para Saldo uma equação química , comece anotando o número de átomos em cada elemento, que é listado no subscrito ao lado de cada átomo. Em seguida, adicione coeficientes aos átomos em cada lado do equação para Saldo eles com os mesmos átomos do outro lado.
