
Índice:
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Última modificação 2025-01-22 17:08.
A soma dos números de oxidação em um íon poliatômico é igual à carga do íon. O número de oxidação do átomo de enxofre no SO42- íon deve ser +6, para exemplo , porque a soma dos números de oxidação dos átomos neste íon deve ser igual a -2.
Da mesma forma, pergunta-se: como você encontra o número de oxidação de íons poliatômicos?
Em um íon poliatômico , a soma de números de oxidação de todos os átomos é igual à carga geral no íon . Por exemplo, em SO2−4, o números de oxidação de S e O são +6 e −2, respectivamente. A soma de tudo números de oxidação no sulfato íon seria 1 (+6) +4 (−2) = - 2, que é a carga do íon.
Saiba também, qual é a soma de todos os números de oxidação em qualquer composto? o soma do números de oxidação do tudo átomos (ou íons) em um neutro composto = 0.
Aqui, qual é a soma dos números de oxidação no íon clorato?
No íon clorato (ClO3-), a número de oxidação de Cl +5, e o número de oxidação de O é -2. Em um átomo ou molécula neutra, o soma dos números de oxidação deve ser 0. Em um poliatômico íon , a soma dos números de oxidação de todos os átomos no íon deve ser igual à carga no íon.
Como você escreve os números de oxidação?
Explicação:
- O número de oxidação de um elemento livre é sempre 0.
- O número de oxidação de um íon monoatômico é igual à carga do íon.
- O número de oxidação de H é +1, mas é -1 quando combinado com menos elementos eletronegativos.
- O número de oxidação de O em compostos é geralmente -2, mas é -1 em peróxidos.
Recomendado:
Qual é o nome do íon poliatômico mno4?

Símbolos e nomes de alguns íons poliatômicos comuns e uma molécula NH4 + íon amônio OH- PO33- íon fosfito MnO4- Fórmulas e nomes para alguns ácidos comuns (todos os nomes devem ter ácido adicionado) H2SO4 H3PO4 sulfúrico
Qual é a fórmula do carbonato de íon poliatômico?

Descrição: O íon carbonato é um íon poliatômico
Qual é a soma dos números opostos?

O oposto de um número é seu inverso aditivo. A soma de um número e seu oposto é zero. (Isso às vezes é chamado de propriedade dos opostos)
Que tipos de números constituem o conjunto de números chamados de números reais?

Conjuntos de números reais (inteiros positivos) ou os números inteiros {0, 1, 2, 3,} (os inteiros não negativos). Os matemáticos usam o termo "natural" em ambos os casos
O que são números naturais, números inteiros, inteiros e números racionais?
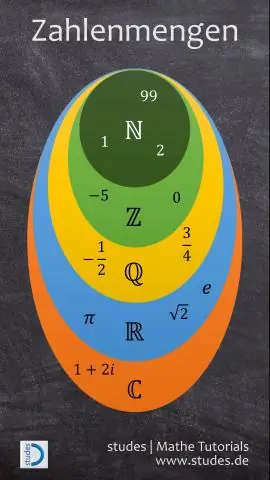
Os números reais são classificados principalmente em números racionais e irracionais. Os números racionais incluem todos os inteiros e frações. Todos os inteiros negativos e números inteiros constituem o conjunto de inteiros. Os números inteiros são compostos por todos os números naturais e zero
